港股生物医药:北海康成CANbridge-B(1228.HK)
发售价已定为每股12.18港元,预期将于2021年12月10日(星期五)上午九时正(香港时间)开始买卖。以每手1,000股股分进行买卖。

一. 公司简介
北海康成成立于2012年,专注于罕见病的生物医药公司,致力于研究、开发及商业化生物科技疗法。有13个管线,包括三个已上市产品、四个处于临床阶段的候选药物、一个处于IND准备阶段、两个处于临床前阶段,另外三个基因治疗项目处于先导识别阶段。管线针对部分最常见的罕见病以及罕见的肿瘤适应症,包括但不限于胶质母细胞瘤(GBM)及黏多糖贮积症II型(MPS II或亨特氏综合症)。

二. 公司研发管线
核心产品CAN008,用于治疗GBM的CD95-Fc糖基化融合蛋白。以及正在开发其他12种候选药物。目前享有合作伙伴Apogenix就CAN008拥有的三项获批专利及两项专利申请的独家权利。正就GBM以外的其他适应症进行研发工作,可能在中短期内就此提出额外的专利申请。
核心产品CAN008
CAN008是一种正开发用于治疗GBM的糖基化CD95-Fc融合蛋白。
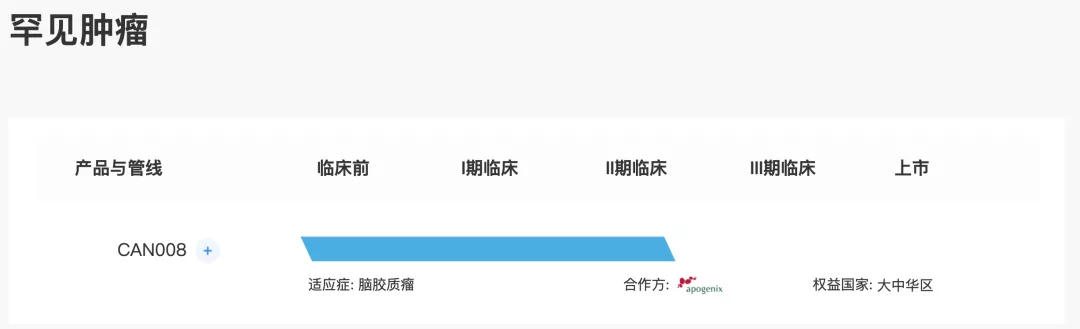
自2016年9月起,经台湾食品药物管理署(「TFDA」)许可,开始在台湾对新诊断为GBM患者进行CAN008联合放射疗法(RT)及替莫唑胺(TMZ)1期试验。Apogenix AG(Apogenix)于2014年9月在欧洲完成复发性GBM中CAN008 2期试验。于2018年9月完成1期试验,结果表明CAN008在GBM患者中总体耐受,并未观察到剂量限制性毒性,无报告任何治疗相关的严重不良事件。于2018年3月就CAN008获得国家药监局IND批准,以进行二线2期试验,且随后根据1期试验初步疗效结果,将IND申请修订为一线2期试验。于2021年4月获批准在中国对GBM患者进行一线2期试验,并于2021年10月在中国进行首例患者给药。2期临床试验设计为多中心、随机、双盲及安慰剂对照研究以调查疗效并探索不同生物标志物与治疗效果间的关系。预期在中国将CAN008商业化,作为合并治疗(放疗加化疗),配合G B M的治疗标准。
其他候选药物
针对MPS II╱亨特氏综合症的Hunterase® (CAN101)
Hunterase® (CAN101)是一种酶替代疗法(ERT),开发用于治疗黏多糖贮积症II型(「MPS II」)。于2019年1月从GC Pharma(或「GC」)获得授权引进Hunterase® (CAN101)。迄今为止,GC已进行多项临床试验以评价Hunterase® (CAN101)的安全性及有效性,包括关键1╱2期试验获得MFDS(前称为韩国食品药品监督管理局或KFDA)的批准及若干批准后研究。关键研究表明受试者获益显著,uGAG水平较基线显著降低,主要终点得到改善。Hunterase® (CAN101)目前由GC Pharma在全球超过10个国家销售。其于2012年1月获得MFDS的孤儿药销售许可。

2020年9月自国家药监局取得用于MPS II的Hunterase® (CAN101)关键试验的临床试验豁免和NDA批准。目前在浙江省参与CAN101风险筛查项目,主要负责对不同测试下的患者进行筛查。
Hunterase® (CAN101)是目前中国唯一可用于MPS II的靶向治疗。在中国和世界范围内,共有8个MPS II靶向药物处于临床阶段。
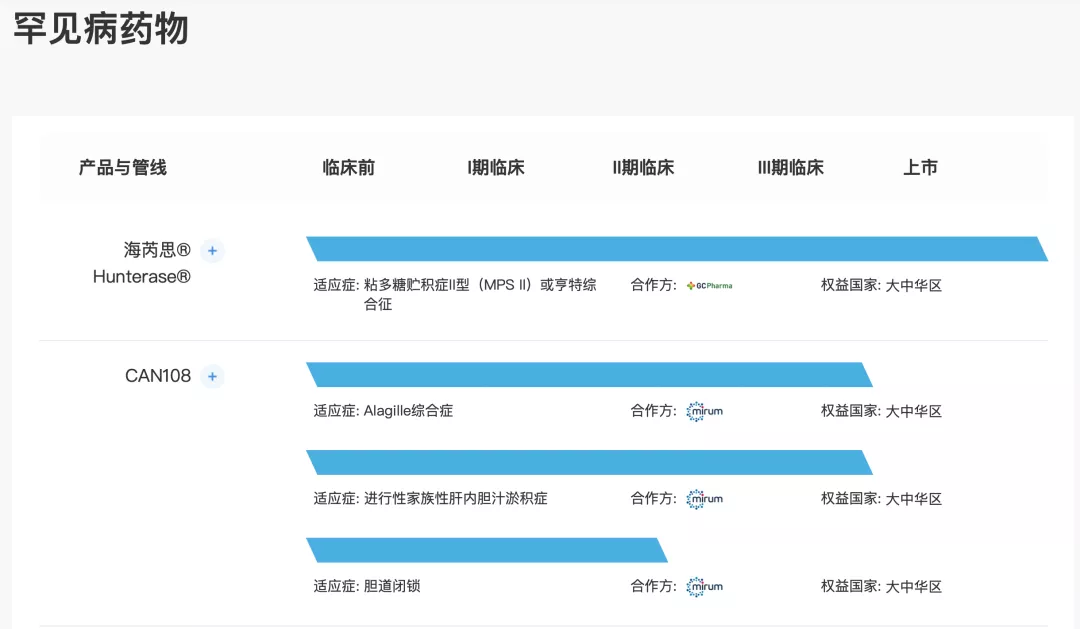
CAN108(maralixibat)
CAN108(maralixibat)为一种口服、最小化吸收的药物,旨在选择性抑制顶端钠依赖性胆汁酸转运蛋白(ASBT)并治疗罕见的胆汁淤积性肝病,包括Alagille综合症(ALGS)、进行性家族性肝内胆汁淤积症(PFIC)及胆道闭锁(BA)。于2021年4月,获得Mirum授予在大中华区开发、制造及商业化用于治疗ALGS、PFIC和BA的CAN108(maralixibat)的独家许可。ASBT主要负责将胆汁酸自肠道循环回至肝脏。ASBT抑制会使更多胆汁酸随粪便排出,导致全身胆汁酸水平降低,从而减少胆汁酸介导的作用及肝损伤。通过在该等环境中靶向胆汁酸,maralixibat有可能改善靶向环境中的长期结果及症状,并提供肝移植的替代治疗方法。Mirum于2021年9月就用于治疗ALGS的maralixibat获得FDA批准。
Maralixibat为目前全球唯一用于治疗ALGS的靶向药物。目前在中国和世界范围内,PFIC和BA都没有获批产品。在中国和世界范围内,分别有一种治疗ALGS的靶向药物、两种治疗PFIC的药物和两种治疗BA的药物正在开发中。
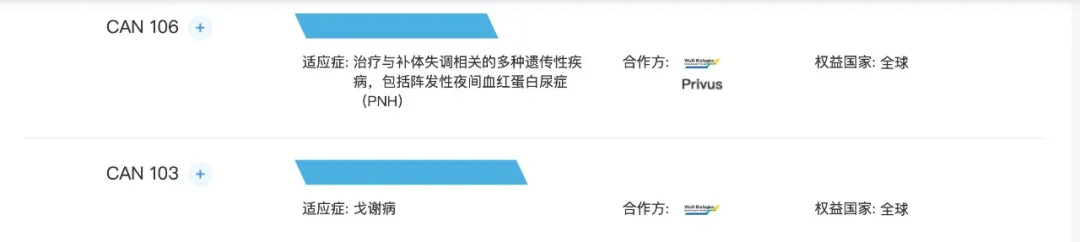
CAN106长效抗C5抗体
CAN106是针对补体C5的人源化单克隆抗体,开发用于治疗补体介导的疾病,包括阵发性睡眠性血红蛋白尿(PNH),以及获批准的抗C5抗体靶向的各种其他补体介导的疾病和其他新的潜在适应症。该分子源自Privus的发现,而药明生物负责CMC的开发。公司已获得Privus及药明生物授予开发该候选药物并将其商业化的全球权利。根据临床前数据,CAN106表现出良好的PK╱PD特征及耐受性,显示CAN106具有在降低给药频率下有效抑制PNH患者C5的潜质。
2021年2月在新加坡对健康志愿者启动CAN106的1期临床试验,并于2021年7月就用于治疗PNH的CAN106的1期研究取得国家药监局的IND批准。
CAN103
CAN103是源自药明生物的发现及正在中国本土开发的针对戈谢病(GD)的ERT,2018年从药明生物收购的首个罕见病药物资产,拥有全球专有的开发和商业化权利。能够产生重组ß-葡萄糖脑苷脂酶(GCase)的工程细胞系产生的,具有高度暴露的甘露糖,可由戈谢病患者的巨噬细胞和柯弗氏细胞有效吸收,从而分解葡萄糖脑苷脂(GL1,一种在GD患者体内积累的脂质)。GD是一种GBA基因突变引发的溶酶体贮积病。2020年,在中国有约3,000名GD患者。
目前有六种针对GD的靶向药物在美国上市,有六种药物正在中国和世界范围内开发。
临床前候选产品

CAN107
CAN107是中国正在开发的治疗X连锁低磷血症(XLH)重组人源抗FGF23单克隆抗体,目前处于CMC阶段筹备进行IND待启动研究。XLH是一种磷酸盐代谢遗传病,基因突变使得X连锁的磷酸盐调节内肽酶同源物(PHEX)基因失活,导致PHEX蛋白失活。PHEX蛋白缺乏╱失活使其无法正确规范成纤维细胞生长因子23(FGF23),导致FGF-23过度活跃,降低了维生素D1α羟化和肾脏的磷酸重吸收,进而导致低磷酸盐血症和相关的遗传性低磷酸佝偻病症状,局部性与系统性的影响有生长缓慢、佝偻、骨骼畸形和肌肉功能障碍。根据弗若斯特沙利文的数据,2020年患病率估计为20,000分之一,该遗传性疾病患病率过去一直保持相对稳定。
CAN104
CAN104是中国正在开发的一种ERT,用于治疗法布雷病(FD)。FD是一种由于α-Gal A的缺乏或不足导致的遗传性鞘糖脂代谢溶酶体储存障碍,可导致危及生命的心脏和肾脏问题。CAN104是一种人源的重组α-半乳糖苷酶A(α-Gal A)。其作用机制是通过先与甘露糖-6-磷酸受主(M6PRs)结合,然后运输到溶酶体,从而使细胞内化。在溶酶体中,CAN104催化globotriaosylceramide(GL-3)和其他α-半乳糖基封端的中性鞘糖脂的水解。我们正在加速CAN104的临床前开发,现时正处于支持IND研究的细胞系开发阶段。FD是最常见的LSD之一,通常于儿童时期发病,在男性中比在女性中更为常见。中国FD患者人数相对较多,约占全球患者的五分之一。
CAN105
CAN105是一种正在开发用于治疗A型血友病的治疗药物,市场潜力巨大。CAN105是一种重组人源化双特异性抗体,可桥接活化因子IX和因子X以恢复缺失的活化因子VIII的功能,预计其不会受到现有因子VIII抑制剂影响或诱导生成新的抑制物。2020年,中国有超过120,000名A型血友病患者,预期2020年至2025年的复合年增长率为0.5%及2025年至2030年的复合年增长率为0.1%。CAN105预期将在2022年上半年进入临床前研究阶段。
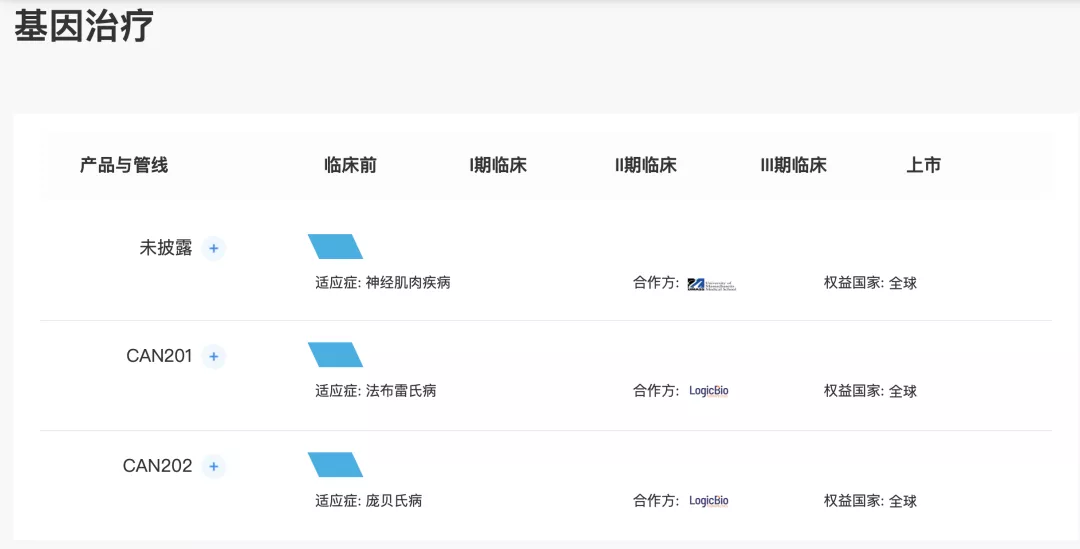
基因疗法-CAN201及CAN202
sL65为用于基因编辑和基因疗法的下一代嗜肝性的AAV衣壳平台。2020年5月举行的美国基因与细胞治疗学会(「ASGCT」)会议上,数据显示衣壳在人源化小鼠模型和非人类灵长类动物中对人肝细胞进行高效的功能转导。数据亦显示衣壳的可制造性得到改善,对人类血清样品中预先存在的中和抗体更具抵抗力。
三. 财务情况
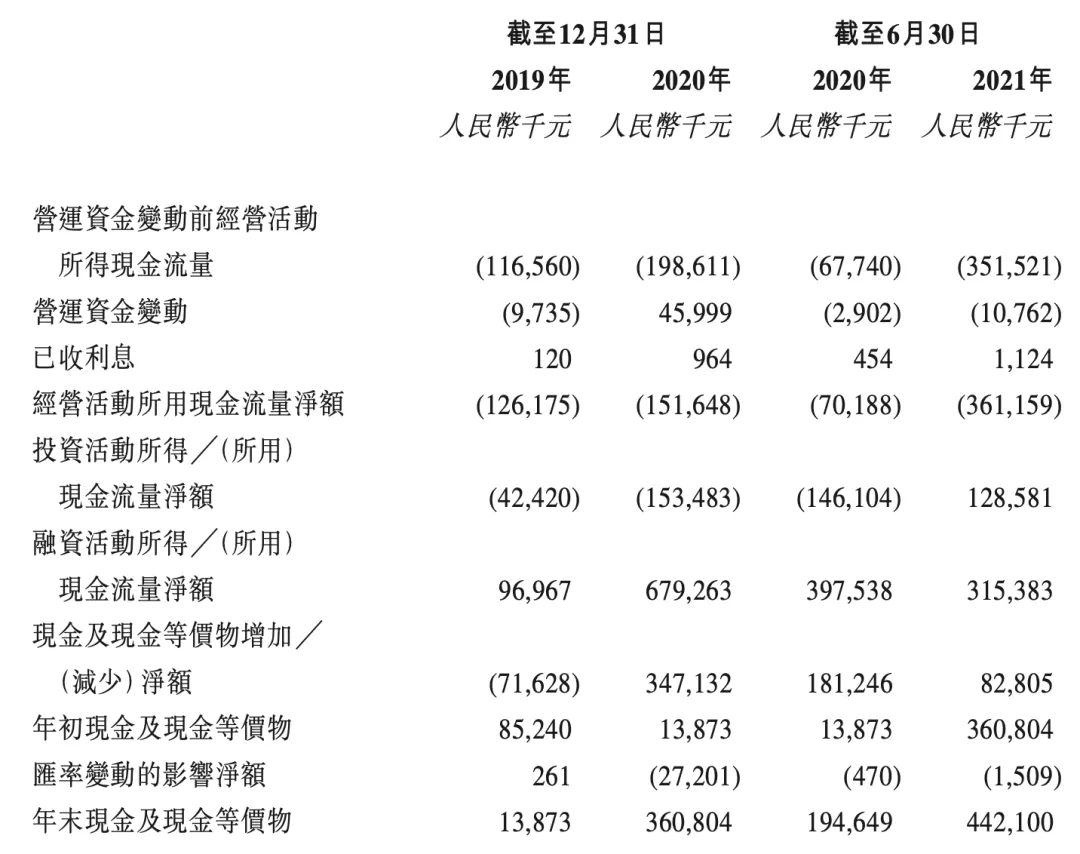
截至2021年9月30日,银行结余及现金人民币352.1百万元。经扣减于全球发售中应支付的包销费用及开支后,假设超额配股权未获行使以及假设发售价为每股发售股分12.18港元,估计将收取约604.0百万港元的所得款项净額。假设未来平均现金消耗率与2020年水平相同,估计截至2021年9月30日的现金及现金等价物将维持14个月的财务稳定。
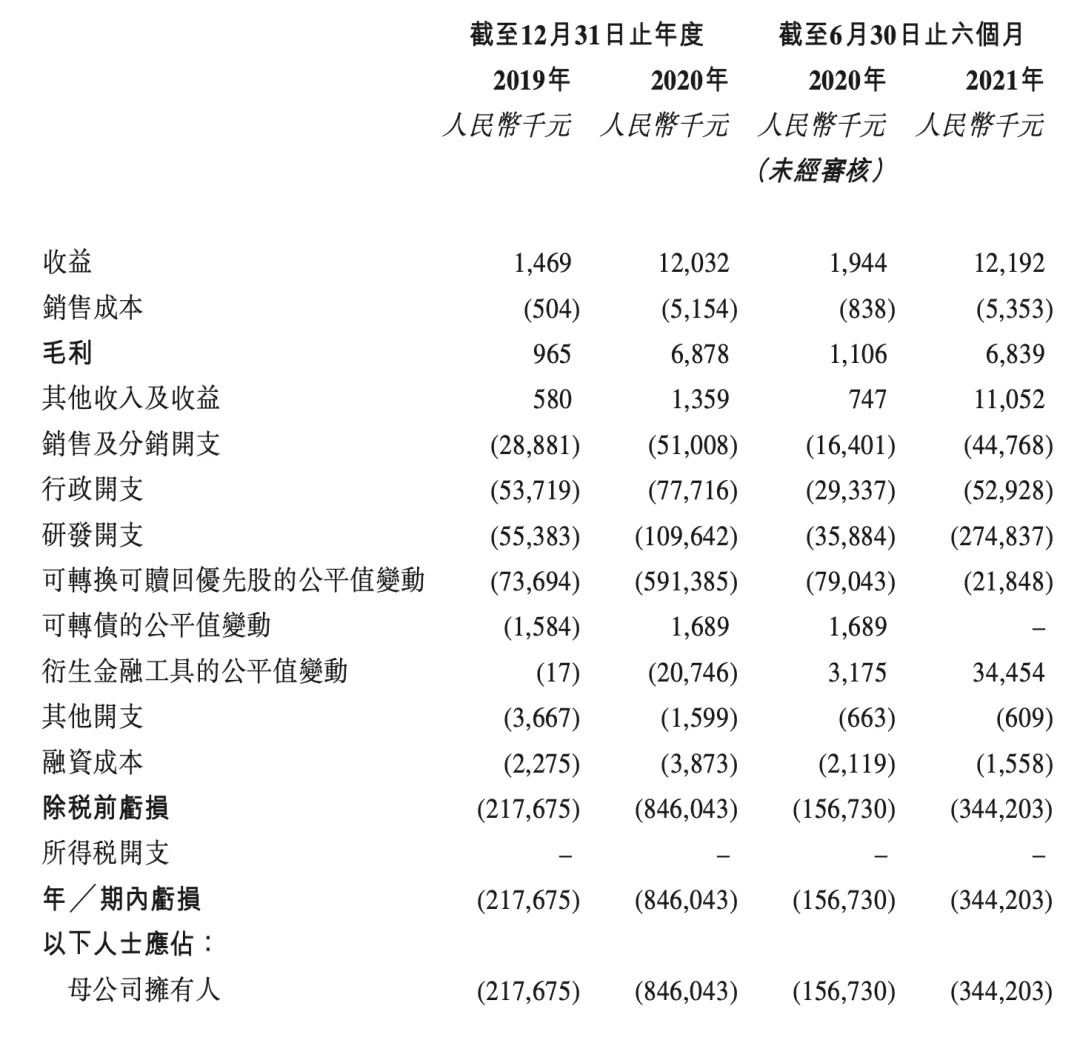
综合损益概要
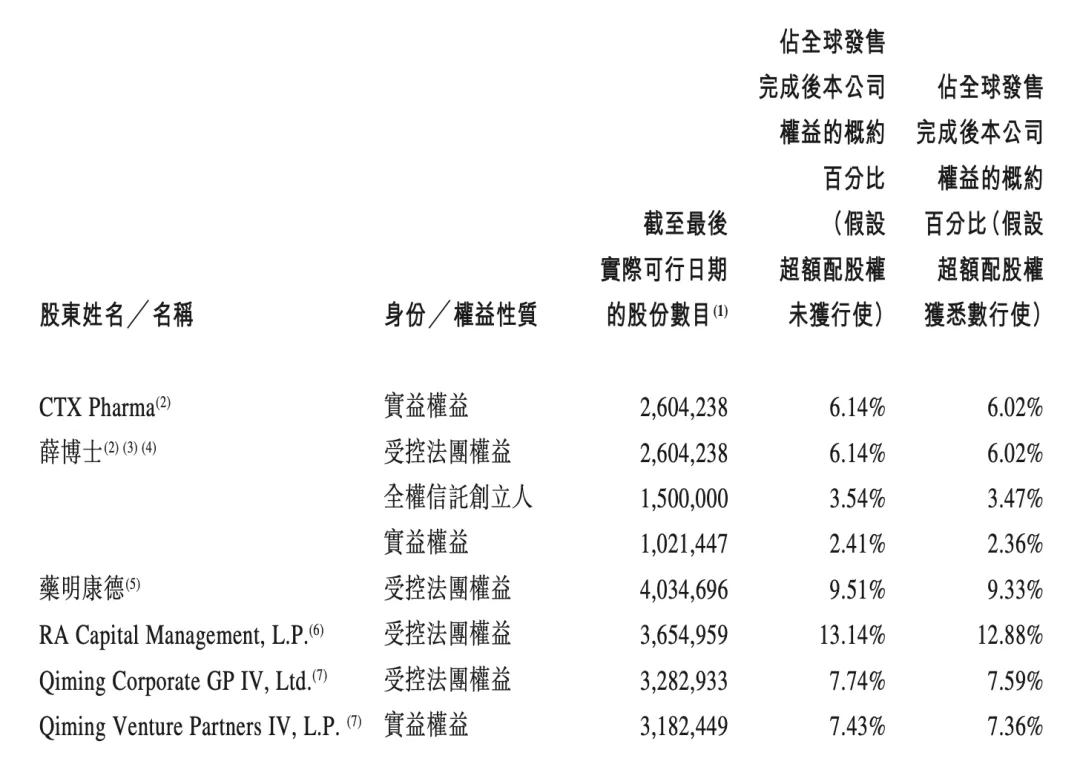
四.持股情况
下图为股东持股情况
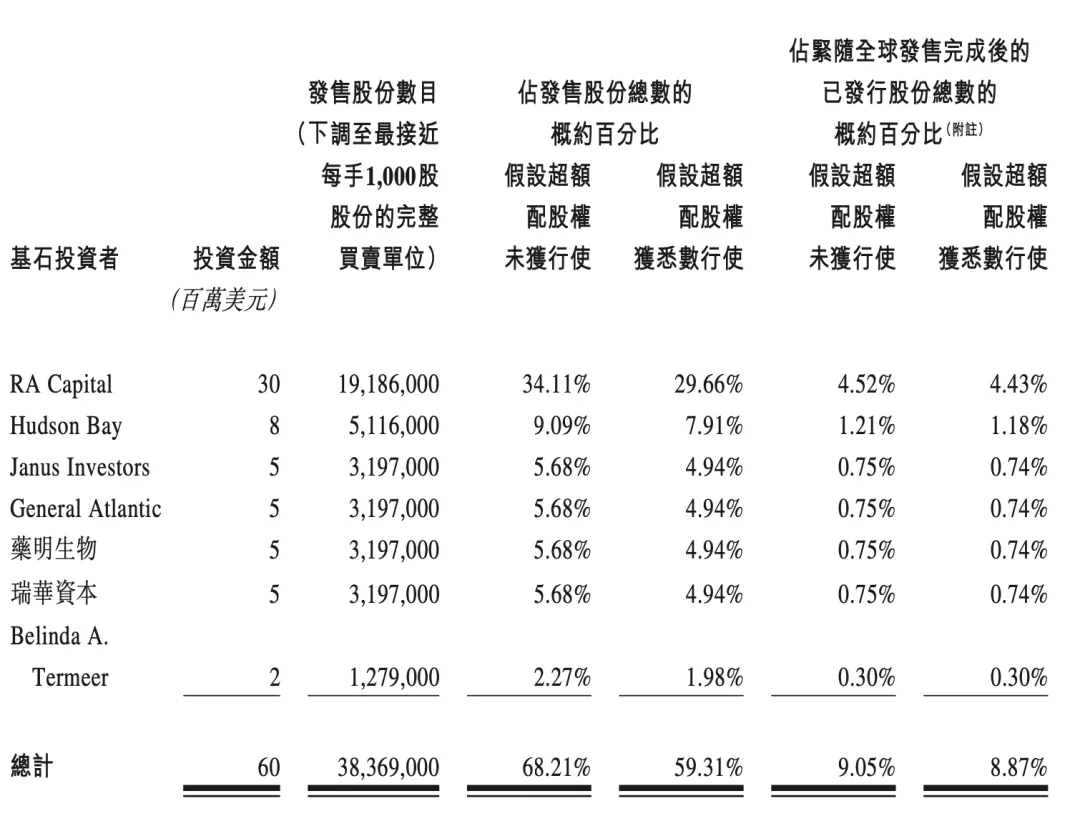
下图为公司基石投资者情况

未经允许不得转载:美股开户者 » 北海康成:罕见病的生物医药公司
 美股开户者
美股开户者